Les technologies d'identification unique des dispositifs permettent d'automatiser la lecture des codes-barres et des identifiants médicaux
Avec la contribution de Rédacteurs nord-américains de DigiKey
2023-10-26
En 2013, la FDA (Food and Drug Administration) aux États-Unis a introduit le système d'identification unique des dispositifs ou règle UDI (Unique Device Identification). Cette règle visait à améliorer la sécurité des patients en fournissant une méthode cohérente de suivi et d'identification des dispositifs médicaux à l'aide d'une documentation moderne aux points de fabrication, de distribution et d'utilisation. À l'instar de la réglementation européenne sur les dispositifs médicaux ou de réglementations similaires dans d'autres pays, la règle UDI américaine améliore la précision des rapports et facilite l'analyse en cas de rappel ou d'événement indésirable.
À compter du 24 septembre 2023, la FDA imposera intégralement les systèmes National Health Related Item Code et Drug Code Numbers sur les étiquettes et emballages des dispositifs. Tous les produits médicaux étiquetés à partir de cette date devront se conformer aux exigences UDI. Ce mandat affectera les produits suivants :
- Produits vitaux de classe 3 tels que les stimulateurs cardiaques et les prothèses implantées
- Produits modérément critiques de classe 2 tels que les seringues, les cathéters et les sutures résorbables
- Produits à faible risque de classe 1 tels que le fil dentaire, les blouses médicales et les masques à oxygène
L'application complète du mandat implique que si un dispositif médical n'est pas muni d'un code-barres scannable, il ne sera plus considéré comme un produit valide/utilisable, même s'il porte des étiquettes lisibles par l'homme et même si le produit est généralement supposé être facilement identifiable par la plupart des utilisateurs. Cette mise en application complète déclenchera l'adoption généralisée par l'industrie médicale et la facturation des assurances maladie.
 Figure 1 : Certains vérificateurs de codes-barres DPM (Direct Part Mark) portables sont dotés d'un éclairage sophistiqué et d'autres logiciels pour localiser automatiquement les symboles et parcourir les paramètres afin d'optimiser la lecture du marquage DPM spécifique et du substrat matériel disponible. En fait, le LVS-9585 illustré ici peut vérifier à la fois les pièces DPM et les étiquettes imprimées pour une analyse et un rapport complets. (Source de l'image : Omron Automation)
Figure 1 : Certains vérificateurs de codes-barres DPM (Direct Part Mark) portables sont dotés d'un éclairage sophistiqué et d'autres logiciels pour localiser automatiquement les symboles et parcourir les paramètres afin d'optimiser la lecture du marquage DPM spécifique et du substrat matériel disponible. En fait, le LVS-9585 illustré ici peut vérifier à la fois les pièces DPM et les étiquettes imprimées pour une analyse et un rapport complets. (Source de l'image : Omron Automation)
L'entité adjudicatrice (porteur de la marque) est responsable
Aux États-Unis, le détenteur de la propriété intellectuelle et la marque de chaque produit médical sont responsables de l'exactitude et de la qualité des codes UDI. Cela est particulièrement important dans la mesure où une grande partie du marché des produits médicaux est sous-traitée et externalisée dans les installations d'autres sociétés. Il incombe donc à la société contractante de veiller à ce que l'ensemble de sa chaîne d'approvisionnement soit conforme à la norme UDI et produise des étiquettes exactes.
Origines de la technologie d'identification unique des dispositifs
Les UDI sont des identificateurs de dispositifs statiques. Cependant, les modifications apportées à la quantité d'articles dans un emballage peuvent nécessiter un nouvel identificateur. Les organismes émetteurs décident de la manière de distinguer ces détails. De la même manière, la modification des conditions de stérilité de l'emballage d'un dispositif peut également modifier l'identificateur du dispositif. La modification du marché de destination d'un dispositif (le pays où le dispositif sera vendu), de la langue de l'étiquette ou du marquage CE peut également nécessiter des modifications de l'identificateur du dispositif.
Avant la règle UDI, un fabricant de dispositifs médicaux pouvait étiqueter un produit avec un numéro de référence spécifique. Le distributeur pouvait changer ce numéro de référence avant que le fournisseur de soins de santé ou l'hôpital ne le modifie à son tour. Avec la possibilité pour chaque entité de modifier le numéro de référence d'un produit avant qu'il ne parvienne au patient, il était presque impossible de suivre les produits, de gérer les rappels, de prévenir la contrefaçon ou de commander avec précision et efficacité de nouveaux stocks.
Document connexe : Relever les défis liés à l'implémentation de solutions de traçabilité robustes
Actuellement, un identificateur standardisé et permanent, appelé UDI, est attribué à chaque dispositif pour permettre à toutes les entités une identification plus rapide et plus précise du dispositif, réduisant ainsi les erreurs médicales. Cet UDI est un code alphanumérique contenant deux données clés :
- Un identificateur de dispositif
- Un identificateur de production
Un identificateur de dispositif est une étiquette statique attribuée à un dispositif donné répertoriant l'étiqueteur (généralement le fabricant du dispositif) et le numéro de modèle spécifique du dispositif. En revanche, un identificateur de production contient des données qui peuvent varier, et la plupart des données qu'il peut contenir sont facultatives. Ces données peuvent inclure des codes de lot, des numéros de série, des dates de péremption et des dates de fabrication. En bref, les données facultatives peuvent inclure tout ce qu'un fabricant ou un étiqueteur juge nécessaire pour prendre en charge le suivi des dispositifs.
Chaque étiquette UDI doit présenter ces informations sous deux formes :
- Sous une forme lisible par l'homme (texte brut)
- Sous une forme lisible par une machine (lisible par un lecteur de codes-barres ou RFID)
Si un dispositif peut remplir plusieurs applications médicales, l'UDI doit être apposé directement sur le dispositif, et non sur son emballage. La règle s'applique également aux dispositifs pouvant être utilisés plusieurs fois.
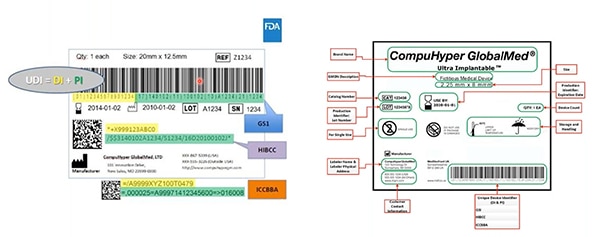 Figure 2 : GS1, HIBCC et ICCBBA — organismes émetteurs d'UDI — créent des UDI, attribuent la symbologie autorisée aux UDI, définissent les technologies pouvant interfacer avec les UDI et spécifient la qualité requise des marques UDI. Les identificateurs de dispositif sont surlignés en jaune, et les identificateurs de production en vert. D'autres éléments incluent des informations lisibles par l'homme … qui sont également codées dans le code-barres lisible par machine. (Source de l'image : FDA)
Figure 2 : GS1, HIBCC et ICCBBA — organismes émetteurs d'UDI — créent des UDI, attribuent la symbologie autorisée aux UDI, définissent les technologies pouvant interfacer avec les UDI et spécifient la qualité requise des marques UDI. Les identificateurs de dispositif sont surlignés en jaune, et les identificateurs de production en vert. D'autres éléments incluent des informations lisibles par l'homme … qui sont également codées dans le code-barres lisible par machine. (Source de l'image : FDA)
Tous les dispositifs doivent être enregistrés dans la base de données UDI mondiale pour permettre le suivi en cas de rappel et pour donner au public l'accès aux informations sur un dispositif donné. Les organismes émetteurs accrédités par la FDA sont autorisés à créer des identificateurs uniques que les fabricants de dispositifs pourront apposer sur leurs produits.
Livre blanc connexe : Staying Current on Traceability
Technologies et techniques de lecture des étiquettes UDI
Les étiquettes UDI peuvent être vérifiées de plusieurs manières tout au long de leur parcours, de la fabrication à l'utilisation.
La vérification en ligne est effectuée par des technologies intégrées dans de grandes machines pour le traitement rapide et précis d'un grand nombre de produits au cours de leur production. Soutenues par des logiciels avancés, ces technologies prennent parfois la forme d'imprimantes d'étiquettes de grade industriel. Ces imprimantes sont capables d'effectuer leur propre vérification en ligne pour confirmer que les informations UDI sont lisibles conformément aux normes rigoureuses de l'industrie immédiatement après leur création au point de production des étiquettes. Par exemple, les vérificateurs V275 d'Omron Automation sont destinés à être utilisés avec les imprimantes thermiques Zebra pour répondre aux normes ISO 15426 et GS1 pour la conformité FDA.
Document connexe : Solutions de traçabilité d'Omron
Ailleurs, la vérification en ligne prend la forme d'une vision industrielle spécialisée qui fonctionne le long des bandes transporteuses sur les lignes de production automatisées, intégrant la lecture de codes-barres pour une vérification extrêmement rapide et précise de l'étiquetage UDI sur différents types de produits sur des lignes de production haute vitesse. Les offres MicroHAWK d'Omron Automation excellent dans ce domaine avec des capteurs avancés soutenus par une construction miniaturisée et des options de connectivité comprenant Ethernet/IP et PROFINET.
Vidéo connexe : Avoid the Liability of Mislabeling
En revanche, la vérification UDI hors ligne est la mieux adaptée à l'échantillonnage par lots d'étiquettes afin de garantir la qualité. Souvent utilisée pour tester des échantillons lorsque des dispositifs médicaux quittent ou arrivent dans un établissement, la vérification hors ligne peut compléter les systèmes de vérification en ligne en amont du parcours de distribution.
 Figure 3 : Les UDI directement marqués sur les produits requièrent des vérificateurs différents de ceux utilisés pour les UDI imprimés sur des étiquettes apposées. (Source de l'image : Omron Automation)
Figure 3 : Les UDI directement marqués sur les produits requièrent des vérificateurs différents de ceux utilisés pour les UDI imprimés sur des étiquettes apposées. (Source de l'image : Omron Automation)
En fait, toutes les opérations de distribution médicale et de soins de santé peuvent bénéficier du recours à des vérificateurs conformes aux normes ISO. Prenons l'exemple des produits de vérification UDI hors ligne de la série LVS-95XX d'Omron. Ces produits sont utilisés comme suit :
- Sur les stations de marquage laser et les imprimantes d'étiquettes où les codes sont créés
- Là où les codes sont appliqués aux produits, dans une zone qui peut ou non être distincte de la zone de création de codes
- Dans les stations de contrôle qualité où les modèles, le formatage et d'autres éléments de code sont confirmés
Spécification des variantes des vérificateurs UDI hors ligne
Le vérificateur UDI hors ligne le mieux adapté pour une application donnée dépend de plusieurs paramètres.
Format de codes-barres : Les grands codes-barres sont souvent plus faciles à scanner grâce à des identificateurs présentant un large champ de vision défini par la distance focale de la lentille et la taille du capteur. Prenons l'exemple des identificateurs UDI de bureau LVS-9510 d'Omron Automation. Cette série de produits peut lire des étiquettes linéaires et 2D. Cinq versions différentes, chacune avec un champ de vision différent, permettent aux concepteurs de sélectionner la version compatible avec la taille du code-barres à vérifier. Une fonction d'assemblage permet d'interpréter les codes-barres qui dépassent le champ de vision.
De plus, tous les dispositifs LVS-9510 peuvent déterminer automatiquement la symbologie et l'ouverture nécessaires pour évaluer le code, et identifier et mettre en évidence les points problématiques.
 Figure 4 : La vérification des codes-barres répondant aux normes ISO est facilitée grâce à un équipement capable de vérifier à la fois les codes linéaires (1D) et les codes bidimensionnels (2D). Certains de ces équipements déterminent la symbologie et l'ouverture nécessaires pour évaluer les codes, et identifient et mettent en évidence les problèmes. Le LVS-9510 illustré ici est doté d'une fonction d'assemblage qui permet d'interpréter les codes-barres dépassant le champ de vision. (Source de l'image : Omron Automation)
Figure 4 : La vérification des codes-barres répondant aux normes ISO est facilitée grâce à un équipement capable de vérifier à la fois les codes linéaires (1D) et les codes bidimensionnels (2D). Certains de ces équipements déterminent la symbologie et l'ouverture nécessaires pour évaluer les codes, et identifient et mettent en évidence les problèmes. Le LVS-9510 illustré ici est doté d'une fonction d'assemblage qui permet d'interpréter les codes-barres dépassant le champ de vision. (Source de l'image : Omron Automation)
Type de codes-barres : Les scanners doivent lire les formats de codes-barres attribués par les organismes émetteurs tels que HIBCC, ICCBBA ou (le plus souvent à partir de 2023) GS1. GS1 dicte la taille, le format et la résolution des codes UPC, des codes-barres linéaires et des codes Datamatrix 2D.
Emplacement du marquage UDI : Considérons le marquage direct des pièces (DPM) des dispositifs médicaux. Ces marquages peuvent être incroyablement petits, surtout lorsqu'ils identifient des instruments chirurgicaux et des dispositifs médicaux implantables. Pour lire et vérifier ces UDI DPM, les vérificateurs portables ultra-haute densité LVS-9580 et LVS-9585 d'Omron sont dotés d'une lentille spécialisée capable d'interpréter une myriade de DPM, y compris ceux dont la taille de cellules est inférieure à 0,05 mm. Les lentilles de grade industriel dans le LVS-9580 et le LVS-9585 garantissent une précision de lecture constante. Les technologies d'éclairage hautement contrôlables et étalonnables à l'intérieur des scanners sont les plus sophistiquées. Outre plusieurs champs de vision, l'éclairage permet l'optimisation immédiate des images UDI capturées. Cela est particulièrement important car la norme de code n'autorise aucune correction ou manipulation d'image par la suite.
Plus d'informations sur le logiciel de scanner UDI
Pour une efficacité maximale, le logiciel UDI prenant en charge le matériel de vérification doit présenter les informations de diagnostic dans un format intuitif. Ce logiciel doit interpréter les codes UDI selon les paramètres définis par l'ISO (en particulier pour confirmer la lisibilité) et idéalement suivre l'aggravation des problèmes sur une série d'analyses UDI.
Omron inclut tous les logiciels nécessaires avec chacun de ses équipements de scan UDI. Les logiciels sont régulièrement mis à jour pour suivre l'évolution rapide des réglementations et des nouvelles législations du secteur.
Une fonction majeure du logiciel de scanner d'Omron consiste à gérer la syntaxe du code. Chaque code-barres ou code 2D doit extraire avec précision toutes les informations pertinentes, notamment le type de produit, le numéro de lot, la quantité applicable, la date d'expiration, les informations d'expédition, etc. Les chaînes de données résultantes doivent être formatées d'une manière particulière pour suivre l'évolution des exigences, méthodologies et destinations des produits médicaux.
Le logiciel régulièrement mis à jour par le fabricant du scanner permet aux utilisateurs finaux de rester à jour, même lorsque de nouveaux codes sont publiés.
Conclusion
L'armée américaine avait autrefois pour objectif d'utiliser pleinement un système de suivi des produits UID tel que le système UDI de l'industrie médicale. Le but était de réduire le gaspillage massif associé aux fournitures perdues, dupliquées et non comptées dans les bases militaires, qu'il s'agisse d'armes Raytheon ou de tableaux de contrôle fournis par une petite entreprise pour une application spécialisée. Aujourd'hui, les UID sont utilisés à des degrés divers.
Le mandat UDI ne connaîtra pas le même sort.
Le mantra qui motive l'adoption UDI est simple : l'étiquette est le produit. Après tout, une étiquette incorrecte peut entraîner une chaîne d'événements faisant perdre du temps au personnel médical et aboutissant au rejet du dispositif médical. C'est pourquoi les UDI doivent figurer sur toutes les couches de l'emballage, c'est-à-dire au niveau de l'unité, du conditionnement, du paquet, de la caisse et de la palette. Les UDI sur les dispositifs médicaux stériles à l'intérieur de scellés de stérilisation sont particulièrement importants, car il est inacceptable de briser le scellé pour vérifier le type de dispositif.
Alors que la FDA exige le plein respect des directives UDI à partir du 24 septembre 2023, les technologies de scanner avancées pour vérifier les produits médicaux deviendront cruciales pour les fabricants d'automatisation ainsi que pour les constructeurs de machines et les utilisateurs finaux.
De tels scanners peuvent satisfaire aux exigences UDI extrêmement spécifiques de la FDA pour confirmer les étiquettes sur un large éventail d'équipements de diagnostics médicaux, cliniques et de laboratoire. Les vérificateurs de codes-barres hors ligne maximisent la traçabilité, la vision industrielle en ligne et les lecteurs DPM avancés.

Avertissement : les opinions, convictions et points de vue exprimés par les divers auteurs et/ou participants au forum sur ce site Web ne reflètent pas nécessairement ceux de DigiKey ni les politiques officielles de la société.









