Schnelles Implementieren von Durchflusszytometer-Designs mit hochpräzisen Datenerfassungsmodulen
Zur Verfügung gestellt von Nordamerikanische Fachredakteure von DigiKey
2022-04-21
Die Durchflusszytometrie wird von Klinikern und Diagnostikern häufig zur Analyse von Zelleigenschaften eingesetzt. Zelle für Zelle bewerten sie optisch unter anderem den Proteingehalt, die Blutgesundheit, die Granularität und die Zellgröße. Obwohl es sich um hochempfindliche Systeme handelt, stehen die Entwickler von Zytometern unter dem ständigen Druck, die Analysezeit zu verkürzen, was neue Ansätze sowohl für die Durchflusszytometrie als auch für die zugehörige Elektronik erfordert.
Zytometer setzen einzelne Zellen dem Laserlicht aus, um Streu- und Fluoreszenzsignale zu erzeugen. Um das entstehende Licht schnell und genau zu erfassen und in digitale Signale umzuwandeln, sind eine Avalanche-Photodiode (APD) und eine komplexe Elektronik erforderlich. Der Entwurf und die Implementierung der Schaltkreise für diesen Prozess kann viel Zeit in Anspruch nehmen, zumal die Datenerfassungssysteme für die Durchflusszytometrie Highspeed-Komponenten mit geringem Rauschen benötigen, um eine hohe Systemgenauigkeit zu gewährleisten.
Um schnellere Durchflusszytometrieanalysen kosteneffizient zu unterstützen, können Entwickler Probleme mit Geschwindigkeit und Genauigkeit mit einer Datenerfassungslösung lösen, die interne Verstärkertreiber und einen Analog/Digital-Wandler (ADC) umfasst.
In diesem Artikel wird kurz dargestellt, wie Durchflusszytometriesysteme funktionieren. Anschließend wird das ADAQ23878 von Analog Devices vorgestellt, ein 18-Bit-ADC-Modul, und es wird gezeigt, wie es für die Entwicklung einer Durchflusszytometer-Detektions- und -Konvertierungsstufe verwendet werden kann. Ein entsprechendes Evaluierungskit wird ebenfalls vorgestellt.
Moderne Grundsätze der Durchflusszytometrie
Die moderne Durchflusszytometrie ist ein automatisiertes Verfahren, das Zell- und Oberflächenmoleküle analysiert, charakterisiert und verschiedene Zelltypen in einer heterogenen Zellpopulation definiert. Abgesehen von der Vorbereitungszeit, die mehr als eine Stunde betragen kann, führt das Gerät eine drei- bis sechsmalige Bewertung von 10.000 Einzelzellen in weniger als einer Minute durch.
Um dies zu ermöglichen, ist der Schritt der Einzelzellpräparation in der Durchflusszytometrie entscheidend. Die Organisation der Proben erfolgt hydrodynamisch in einer Hüllflüssigkeit, um die Zellen oder Partikel in einem engen, Probenstrom für die Analyse zu bündeln. Bei dieser Umwandlung müssen die einzelnen Zellen ihre natürlichen biologischen Eigenschaften und biochemischen Bestandteile beibehalten.
Abbildung 1 zeigt ein Diagramm eines Durchflusszytometers, das oben mit der Mehrfachzellenprobe beginnt.
 Abbildung 1: Schema eines Durchflusszytometers, von der Hüllenfokussierung bis zur Datenerfassung. (Bildquelle: : Wikipedia, modifiziert von Bonnie Baker)
Abbildung 1: Schema eines Durchflusszytometers, von der Hüllenfokussierung bis zur Datenerfassung. (Bildquelle: : Wikipedia, modifiziert von Bonnie Baker)
Die sechs Hauptkomponenten des Durchflusszytometers sind eine Durchflusszelle, ein Laser, eine Avalanche-Photodiode (APD), ein Transimpedanzverstärker (TIA), ein ADC und ein Computer zur Datenerfassung und -analyse.
Das Durchflusszytometer verfügt über einen Flüssigkeitsstrom, auch Hüllflüssigkeit genannt, die verengt ist, um die Zellen in einer einzigen Reihe durch den Lichtstrahl zu führen und auszurichten. Das Laserlicht erfasst eine Zelle nach der anderen und erzeugt ein Vorwärtsstreulichtsignal (FSC) und ein Seitenstreulichtsignal (SSC). Das Fluoreszenzlicht wird mit Hilfe von Spiegeln und Filtern sortiert und anschließend durch eine APD verstärkt.
Der nächste Schritt ist die Erkennung, Digitalisierung und Analyse der resultierenden Lichtleistung, nachdem sie auf die APD trifft. Der 500-Megahertz-FET-Eingangs-Operationsverstärker LTC6268 von Analog Devices mit extrem niedrigem Bias-Strom und geringem Spannungsrauschen ist ideal für die Highspeed-TIA, die für die Detektion benötigt wird.
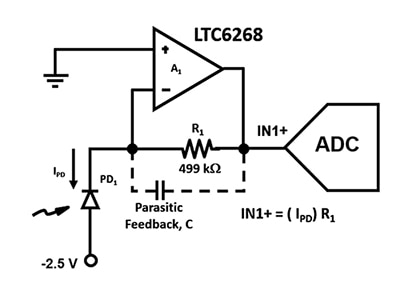 Abbildung 2: Die TIA-Schaltung verwendet eine APD (PD1) und einen FET-Operationsverstärker mit niedrigem Eingangsstrom, um extrem niedrige Fotodiodenströme in eine Ausgangsspannung an IN1+ umzuwandeln. (Bildquelle: Bonnie Baker)
Abbildung 2: Die TIA-Schaltung verwendet eine APD (PD1) und einen FET-Operationsverstärker mit niedrigem Eingangsstrom, um extrem niedrige Fotodiodenströme in eine Ausgangsspannung an IN1+ umzuwandeln. (Bildquelle: Bonnie Baker)
Es ist wichtig, diese Verstärkerschaltung mit einer möglichst großen Bandbreite zu entwerfen, daher müssen parasitäre Kapazitäten minimiert werden. Zum Beispiel beeinflusst die parasitäre Rückkopplungskapazität C die Stabilität und Bandbreite der Schaltung in Abbildung 2. Unabhängig von der Wahl des Widerstandsgehäuses wird es immer eine parasitäre Kapazität im Rückkopplungspfad des Verstärkers geben. Für Highspeed-Anwendungen ist jedoch ein 0805-Gehäuse vorzuziehen, das einen größeren Abstand zwischen den Endkappen und die geringste parasitäre Kapazität aufweist.
Eine Vergrößerung des Abstands zwischen den Endkappen von R1 ist nicht die einzige Möglichkeit, die Kapazität zu verringern. Eine weitere Möglichkeit zur Verringerung der Kapazität von Platte zu Platte besteht darin, die E-Feldpfade, die die parasitäre Kapazität verursachen, abzuschirmen, indem eine zusätzliche Massebahn unter dem Widerstand R1 angebracht wird (Abbildung 3).
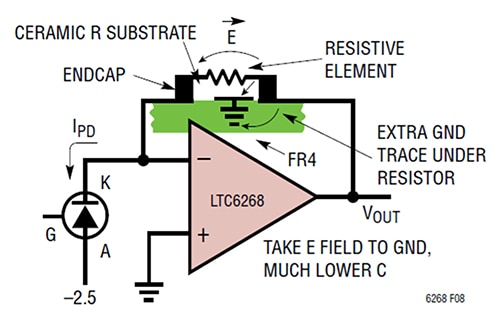 Abbildung 3: Durch Hinzufügen einer Masseleitung unter dem Rückkopplungswiderstand wird das E-Feld von der Rückkopplungsseite abgeleitet und auf Masse gelegt. (Bildquelle: Analog Devices)
Abbildung 3: Durch Hinzufügen einer Masseleitung unter dem Rückkopplungswiderstand wird das E-Feld von der Rückkopplungsseite abgeleitet und auf Masse gelegt. (Bildquelle: Analog Devices)
In diesem Fall besteht die Methode insbesondere darin, eine kurze Masseleitung unter und zwischen den Widerstandspads in der Nähe des TIA-Ausgangs zu platzieren. Diese Technik ergibt einen parasitären Kapazitätswert von 0,028 Picofarad (pF) mit einer TIA-Bandbreite von 1/(2π*RF*CPARASITIC), was 11,4 MHz entspricht.
Die optischen Lichtsignale werden auf mehrere Avalanche-Dioden mit entsprechenden optischen Filtern gerichtet. Das APD-, TIA- und ADC-System wandelt diese Signale in ihre digitale Darstellung um und sendet die Daten zur weiteren Analyse an den Mikroprozessor.
Moderne Geräte verwenden in der Regel mehrere Laser und APDs. Die aktuellen kommerziellen Geräte nutzen zehn Laser und dreißig Avalanche-Photodioden. Die Erhöhung der Anzahl der Laser und Fotovervielfacher-Detektoren ermöglicht die mehrfache Markierung von Antikörpern, um Zielpopulationen anhand phänotypischer Marker genau zu identifizieren.
Die Geschwindigkeit der Analyse hängt jedoch von einem ausgewogenen Verhältnis ab zwischen:
- der Geschwindigkeit der Hüllflüssigkeit
- der Fähigkeit des hydrodynamischen Fokussierverfahrens zur Bildung von Einzelzellströmen
- des Tunneldurchmessers
- der Fähigkeit, die Integrität einer Zelle zu bewahren
- der Elektronik
Akustische Fokussierung bei der Durchflusszytometrie
Der Einsatz mehrerer Laser und APDs beschleunigt zwar die Analyse und Identifizierung, aber die neuesten modernen Durchflusszytometrieverfahren für Einzelzellen können bestenfalls Daten von bis zu einer Million einzelner Zellen pro Minute erfassen. Für viele Anwendungen, wie z. B. den Nachweis von zirkulierenden Tumorzellen im Blut mit einer Konzentration von nur 100 Zellen pro Milliliter, ist dies jedoch unzureichend. Bei klinischen Anwendungen für seltene Zellen erfordern die Tests regelmäßig die zeitaufwändige Analyse von Milliarden von Zellen.
Die Alternative zum hydrodynamisch fokussierten Zellpräparationsverfahren ist ein akustisches Fokussierungsverfahren. Dabei wird ein piezoelektrisches Material wie Blei-Zirkonat-Titanat (PZT) an einer Glaskapillare angebracht, um elektrische Impulse in mechanische Schwingungen umzuwandeln (Abbildung 4a). Durch den Einsatz eines PZT, das die Seitenwände einer Glaskapillare bei der Resonanzfrequenz der rechteckigen Durchflusszelle in Schwingung versetzt, erzeugt das System eine Vielzahl von stehenden akustischen Wellen mit einer unterschiedlichen Anzahl von Druckknoten.
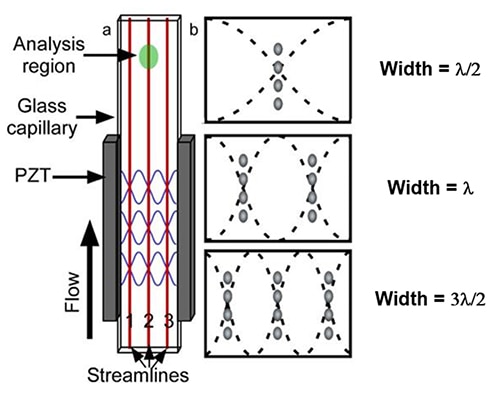 Abbildung 4: Illustration einer akustischen Durchflusszelle mit einer rechteckigen Glaskapillare (a). Die Lage der ersten drei Druckknoten für eine Kapillare mit fester Breite (b). (Bildquelle: National Center for Biotechnology Information)
Abbildung 4: Illustration einer akustischen Durchflusszelle mit einer rechteckigen Glaskapillare (a). Die Lage der ersten drei Druckknoten für eine Kapillare mit fester Breite (b). (Bildquelle: National Center for Biotechnology Information)
Diese PZT-Frequenzknoten richten fließende Partikel in mehreren, diskreten Stromlinien aus (Abbildung 4b). Die akustische Durchflusszelle nutzt eine lineare, stehende akustische Welle, um sich durch die Erzeugung einzelner oder mehrerer Oberwellen auf verschiedene Wellenlängen einzustellen. Wie durch das einfache lineare Stehwellenmodell vorhergesagt, bilden die Zellen in der Probe einzelne oder zahlreiche Einzelzelllinien innerhalb der Durchflusskammer.
Mit dieser präzisen Anordnung der Zellen kann die Breite des Tunnels für die Hüllenflüssigkeit erweitert werden, um schnellere Flussraten am Laserstrahl vorbei zu ermöglichen (Abbildung 5).
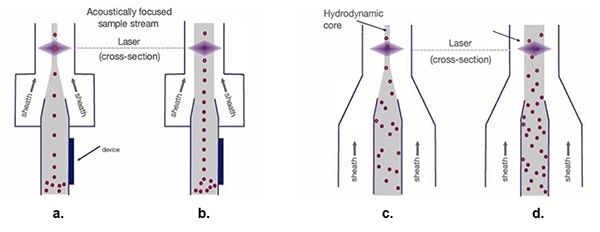 Abbildung 5: Mit dem hydrodynamischen Probenstrom (c. und d.), streuen die Zellproben mit zunehmender Hüllenbreite, was den optischen Messprozess erschwert. Akustisch fokussierte Probenströme (a. und b.) erhalten einreihige Zellenströme unabhängig von der Breite der Hülle. (Bildquelle: Thermo Fischer Scientific)
Abbildung 5: Mit dem hydrodynamischen Probenstrom (c. und d.), streuen die Zellproben mit zunehmender Hüllenbreite, was den optischen Messprozess erschwert. Akustisch fokussierte Probenströme (a. und b.) erhalten einreihige Zellenströme unabhängig von der Breite der Hülle. (Bildquelle: Thermo Fischer Scientific)
Bei der traditionellen hydrodynamischen Fokussierung (Abbildung 5c) werden die Zellen zur Vorbereitung des Laserscannens in einen Strom aus Einzelzellen angeordnet. Ein breiterer Trichter für den Kern des Probenstroms ermöglicht zwar eine höhere Geschwindigkeit des Hüllmaterials (Abbildung 5d), führt aber auch zu einer Ausbreitung der Einzelzellorganisation, was zu Signalschwankungen und einer schlechteren Datenqualität führt.
Die akustische Fokussierung (Abbildung 5a) positioniert biologische Zellen und andere Partikel selbst bei einem breiteren Tunnel in enger Ausrichtung. Diese präzise Ausrichtung der Zellen ermöglicht höhere Abtastraten bei gleichbleibender Datenqualität (Abbildung 5b).
In der Praxis erhöht die akustische Fokussierung der Durchflusszytometrie die Häufigkeit der Zellprobenahme um das ca. 20-fache (Abbildung 6).
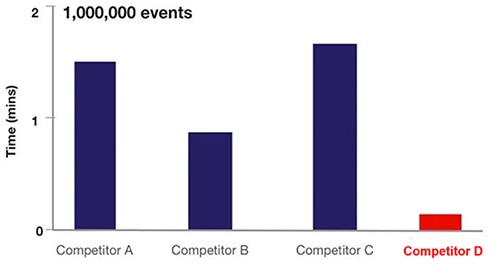 Abbildung 6: Vergleich der Probenahmezeit für verschiedene Durchflusszytometriegeräte auf der Grundlage der Flüssigkeitsdurchflusszytometrie (A, B, C) und der akustischen Fokussierungszytometrie (D). (Bildquelle: Thermo Fischer Scientific)
Abbildung 6: Vergleich der Probenahmezeit für verschiedene Durchflusszytometriegeräte auf der Grundlage der Flüssigkeitsdurchflusszytometrie (A, B, C) und der akustischen Fokussierungszytometrie (D). (Bildquelle: Thermo Fischer Scientific)
In Abbildung 6 verwenden die Geräte von A, B und C die hydrodynamische Technologie, während in D die akustische Fokussierungszytometrie zum Einsatz kommt.
Datenerfassung bei der akustisch fokussierenden Durchflusszytometrie
Das Design der Elektronik für die akustische Fokussierung von Durchflusszytometern erfordert eine Highspeed-Photosensorik, um die Geschwindigkeit der Blutzellen und der Hüllenflüssigkeit durch die Düse mit dem größeren Durchmesser zu bewältigen. Der bereits erwähnte 600-MHz-Highspeed-LTC6268 ermöglicht in Kombination mit einem speziellen 0805-Widerstandsgehäuse eine optische Abtastrate von bis zu 11,4 MHz (Abbildung 7, links). Die Ausgabe des LTC6268 wird zur Digitalisierung an den ADC ADAQ23878 von Analog Devices weitergeleitet.
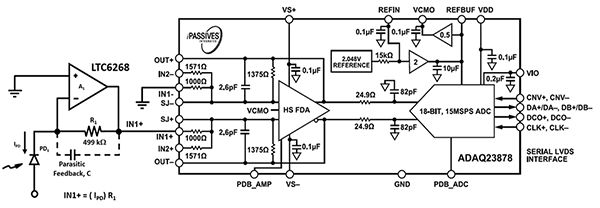 Abbildung 7: Der ADC ADAQ23878 digitalisiert das optische Signal von der Fotodiode (PD1) und der TIA-Schaltung (links). (Bildquelle: Bonnie Baker)
Abbildung 7: Der ADC ADAQ23878 digitalisiert das optische Signal von der Fotodiode (PD1) und der TIA-Schaltung (links). (Bildquelle: Bonnie Baker)
Der ADAQ23878 ist ein präzises 18-Bit-Highspeed-SIP (System-in-Package) mit 15 Megasamples pro Sekunde (MS/s) für die Datenerfassung. Er verkürzt den Entwicklungszyklus von Präzisionsmesssystemen erheblich, indem er den Entwicklungsaufwand für die Auswahl, Optimierung und das Layout der Eingangstreiberkomponenten vom Entwickler auf das Gerät überträgt.
Der modulare Ansatz des SIP reduziert die Anzahl der Endsystemkomponenten, indem er mehrere gemeinsame Signalverarbeitungs- und -aufbereitungsblöcke in einer einzigen Komponente zusammen mit dem Highspeed-ADC mit 18 Bit und 15 MS/s (sukzessive Approximation) kombiniert. Diese Blöcke umfassen einen rauscharmen, volldifferentiellen ADC-Treiberverstärker und einen stabilen Referenzpuffer.
Der ADAQ23878 enthält auch die kritischen passiven Komponenten, die die iPassive-Technologie von Analog Devices nutzen, um temperaturabhängige Fehlerquellen zu minimieren und die Leistung zu optimieren. Die schnell einschwingende Treiberstufe des ADC trägt dazu bei, eine schnelle Datenerfassung zu gewährleisten.
Evaluierung des µModules ADAQ23878
Zur Evaluierung des ADAQ23878 bietet Analog Devices das Evaluierungsboard EVAL-ADAQ23878FMCZ an (Abbildung 8). Das Board demonstriert die Leistungsfähigkeit des μModuls ADAQ23878 und ist ein vielseitiges Werkzeug zur Evaluierung eines Frontend-Designs für die Durchflusszytometrie und einer Vielzahl anderer Anwendungen.
 Abbildung 8: Die Evaluierungsplatine EVAL-ADAQ23878FMCZ für den ADAQ23878 verfügt über Versorgungskreise auf der Platine, wird mit zugehöriger Software zur Steuerung und Datenanalyse geliefert und ist SDP-H1-kompatibel. (Bildquelle: Analog Devices)
Abbildung 8: Die Evaluierungsplatine EVAL-ADAQ23878FMCZ für den ADAQ23878 verfügt über Versorgungskreise auf der Platine, wird mit zugehöriger Software zur Steuerung und Datenanalyse geliefert und ist SDP-H1-kompatibel. (Bildquelle: Analog Devices)
Das Evaluierungsboard EVAL-ADAQ23878FMCZ erfordert einen PC mit Windows 10 oder höher, eine rauscharme Präzisionssignalquelle und einen für 18-Bit-Tests geeigneten Bandpassfilter. Das Evaluierungsboard benötigt das ADAQ23878-ACE-Plugin und den SPD-H1-Treiber.
Fazit
Die Untersuchung einer biologischen Zelle nach der anderen unter Verwendung von Standardtechniken der hydrodynamisch fokussierenden Durchflusszytometrie hat sich bewährt, aber mit dem Bedarf an schnelleren Analysen hat eine Verlagerung zu Techniken stattgefunden, die auf akustisch fokussierenden Durchflussmethoden basieren. Aber auch die Elektronik, die die fortschrittlichere Durchflusszytometrie unterstützt, muss verbessert werden, während gleichzeitig der Platzbedarf, die Kosten und die Entwicklungszeit minimiert werden.
Wie gezeigt, lassen sich der Highspeed-Operationsverstärker LTC6268 und das Präzisions-Highspeed-μModul ADAQ233878 zu einem kompletten Datenerfassungssystem für moderne Durchflusszytometriegeräte kombinieren.

Haftungsausschluss: Die Meinungen, Überzeugungen und Standpunkte der verschiedenen Autoren und/oder Forumsteilnehmer dieser Website spiegeln nicht notwendigerweise die Meinungen, Überzeugungen und Standpunkte der DigiKey oder offiziellen Politik der DigiKey wider.







