Technologien zur eindeutigen Identifizierung von Komponenten automatisieren das Lesen von medizinischen ID- und Barcodes
Zur Verfügung gestellt von Nordamerikanische Fachredakteure von DigiKey
2023-10-26
Im Jahr 2013 führte die US Food and Drug Administration (FDA) das Unique Device Identification System bzw. die UDI-Vorschrift ein. Die Vorschrift zielt darauf ab, die Patientensicherheit zu verbessern, indem sie eine einheitliche Methode zur Rückverfolgung und Identifizierung von Medizinprodukten unter Verwendung moderner Dokumentation an den Herstellungs-, Vertriebs- und Verwendungsstellen vorsieht. Ähnlich wie die Vorschriften für Medizinprodukte in Europa oder ähnliche Vorschriften in anderen Ländern erhöht die UDI-Vorschrift in den USA die Genauigkeit der Berichterstattung und erleichtert die Analyse im Falle eines Rückrufs oder unerwünschter Ereignisse.
Ab dem 24. September 2023 wird die FDA den National Health Related Item Code und die Drug Code Numbers auf Produktetiketten und -verpackungenvollständig durchsetzen. Alle Medizinprodukte, die an oder nach diesem Datum gekennzeichnet werden, müssen den UDI-Vorschriften vollständig entsprechen. Dieses Mandat wird sich auf Folgendes auswirken:
- Lebenswichtige Produkte der Klasse 3 wie Herzschrittmacher und implantierte Prothesen
- Mäßig kritische Produkte der Klasse 2 wie Spritzen, Katheter und absorbierbares Nahtmaterial
- Produkte der Klasse 1 mit geringerem Risiko, wie Zahnseide, medizinische Kittel und Sauerstoffmasken
Die vollständige Durchsetzung des Mandats bedeutet, dass ein Medizinprodukt, das nicht mit einem einlesbaren Barcode versehen ist, nicht mehr als gültiges/verwendbares Produkt gilt, selbst wenn es mit von Menschen lesbaren Etiketten versehen ist und selbst wenn allgemein davon ausgegangen wird, dass das Produkt von den meisten Benutzern leicht identifiziert werden kann. Diese vollständige Durchsetzung wird die umfassende Übernahme durch die medizinische Industrie und die Abrechnung mit den Krankenkassen vorantreiben.
 Abbildung 1: Einige tragbare DPM-Barcode-Prüfgeräte verfügen über eine fortschrittliche Beleuchtung und Software, die automatisch Symbole findet und Einstellungen durchläuft, um das Lesen der spezifischen DPM-Marke und des jeweiligen Materials zu optimieren. Das hier gezeigte LVS-9585 kann sowohl DPM-Teile als auch gedruckte Etiketten für umfassende Analysen und Berichte überprüfen. (Bildquelle: Omron Automation)
Abbildung 1: Einige tragbare DPM-Barcode-Prüfgeräte verfügen über eine fortschrittliche Beleuchtung und Software, die automatisch Symbole findet und Einstellungen durchläuft, um das Lesen der spezifischen DPM-Marke und des jeweiligen Materials zu optimieren. Das hier gezeigte LVS-9585 kann sowohl DPM-Teile als auch gedruckte Etiketten für umfassende Analysen und Berichte überprüfen. (Bildquelle: Omron Automation)
Der Auftraggeber (Markenträger) ist verantwortlich
In den USA ist der Inhaber des geistigen Eigentums und die benutzerseitige Marke eines jeden Medizinprodukts für die Richtigkeit und Qualität der UDI-Codes verantwortlich. Dies ist besonders wichtig, da ein großer Teil des Marktes für medizinische Produkte in Auftragsfertigung hergestellt und an Einrichtungen anderer Unternehmen ausgelagert wird. Daher liegt es in der Verantwortung der auftraggebenden Organisation, sicherzustellen, dass ihre gesamte Lieferkette UDI-konform ist und korrekte Etiketten erstellt.
Ursprünge der Technologie zur eindeutigen Geräteidentifizierung
UDIs sind statische Gerätekennungen. Allerdings kann eine Änderung der Anzahl der Artikel in einem Packstück eine neue Kennung erforderlich machen. Die ausstellenden Stellen legen fest, wie diese Angaben zu unterscheiden sind. In gleicher Weise kann eine Änderung der Sterilitätsbedingungen für die Verpackung eines Produkts auch eine Änderung der Produktkennung zur Folge haben. Eine Änderung des Bestimmungsmarktes (das Land, in dem ein Produkt verkauft werden soll), der Sprache des Etiketts oder der CE-Kennzeichnung kann ebenfalls eine Änderung der Produktkennzeichnung erforderlich machen.
Vor dem Inkrafttreten der UDI-Vorschrift konnte ein Hersteller von Medizinprodukten ein Produkt mit einer bestimmten Teilenummer kennzeichnen. Der Händler würde diese Teilenummer ändern, bevor der Gesundheitsdienstleister oder das Krankenhaus sie wieder ändern würde. Da jedes Unternehmen die Möglichkeit hatte, die Teilenummer zu ändern, bevor sie den Patienten erreichte, war es nahezu unmöglich, Produkte zu verfolgen, Rückrufe zu handhaben, Fälschungen zu verhindern oder neue Waren effizient zu bestellen.
Verwandt: Implementierung von robusten Rückverfolgbarkeitslösungen
Gegenwärtig wird jedes Gerät mit einer standardisierten und dauerhaften Kennung, der so genannten UDI, versehen, um allen Beteiligten eine schnellere und präzisere Identifizierung des Geräts zu ermöglichen und letztlich medizinische Fehler zu vermeiden. Diese UDI ist ein alphanumerischer Code, der zwei Schlüsseldaten enthält:
- Eine Gerätekennung
- Ein Produktionskennzeichen
Eine Gerätekennung ist ein statisches Etikett, das einem bestimmten Gerät zugewiesen wird und auf dem der Etikettierer (in der Regel der Gerätehersteller) und die spezifische Modellnummer des Geräts angegeben sind. Im Gegensatz dazu enthält ein Produktionskennzeichen Daten, die variieren können, und viele der Daten, die er enthalten kann, sind optional. Diese können Los- und Chargencodes, Seriennummern, Verfallsdaten und Herstellungsdaten umfassen. Kurz gesagt, die optionalen Daten können alles sein, was ein Hersteller oder Etikettierer zur Unterstützung der Geräteverfolgung für notwendig hält.
Jedes UDI-Etikett muss diese Informationen in zwei Formen enthalten:
- Menschenlesbare Form (einfacher Text)
- Maschinenlesbare Form (lesbar mit einem Barcode- oder RFID-Lesegerät)
Wenn ein Produkt mehrere medizinische Anwendungen erfüllen kann, muss die UDI direkt auf dem Produkt und nicht auf der Verpackung angegeben werden. Die Regel gilt auch für Geräte, die mehrfach verwendet werden können.
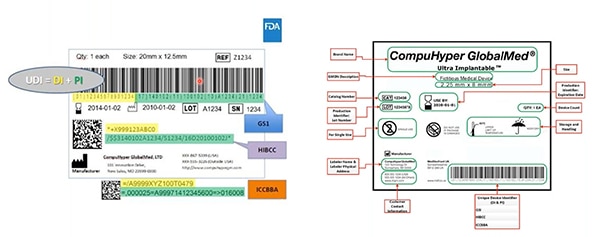 Abbildung 2: GS1, HIBCC und ICCBBA - die UDI-Vergabestellen - erstellen UDIs, weisen den UDIs zulässige Symbole zu, legen fest, welche Technologien mit UDIs verbunden werden können, und bestimmen die erforderliche Qualität der UDI-Marken. In diesem Beispiel ist die Gerätekennung gelb hervorgehoben; grün hervorgehoben sind die Produktionskennungen. Andere Elemente beinhalten von Menschen lesbare Informationen ... diese sind ebenfalls in dem maschinenlesbaren Barcode kodiert. (Bildquelle: FDA)
Abbildung 2: GS1, HIBCC und ICCBBA - die UDI-Vergabestellen - erstellen UDIs, weisen den UDIs zulässige Symbole zu, legen fest, welche Technologien mit UDIs verbunden werden können, und bestimmen die erforderliche Qualität der UDI-Marken. In diesem Beispiel ist die Gerätekennung gelb hervorgehoben; grün hervorgehoben sind die Produktionskennungen. Andere Elemente beinhalten von Menschen lesbare Informationen ... diese sind ebenfalls in dem maschinenlesbaren Barcode kodiert. (Bildquelle: FDA)
Alle Produkte müssen in der globalen UDI-Datenbank registriert werden, um im Falle eines Rückrufs die Rückverfolgung zu ermöglichen und der Öffentlichkeit Zugang zu Informationen über ein bestimmtes Produkt zu geben. Die von der FDA akkreditierten Vergabestellen sind befugt, eindeutige Kennzeichnungen zu erstellen, die die Hersteller von Produkten auf ihren Produkten anbringen können.
Zugehöriger englischer Hintergrundartikel: Staying Current on Traceability
UDI-Scan-Technologien und -Techniken
UDI-Etiketten können auf ihrem Weg von der Herstellung bis zur Verwendung auf verschiedene Weise überprüft werden.
Die Inline-Prüfung erfolgt durch Technologien, die in größere Maschinen integriert sind und eine schnelle und genaue Verarbeitung großer Mengen von Produkten während der Produktion ermöglichen. Diese Technologien werden durch moderne Software unterstützt und nehmen gelegentlich die Form von Etikettendruckern für den industriellen Einsatz an. Diese Drucker sind in der Lage, eine eigene Inline-Prüfung durchzuführen, um zu bestätigen, dass die UDI-Informationen sofort nach ihrer Erstellung am Ort der Etikettenproduktion gemäß den strengen Industriestandards lesbar sind. Die V275-Prüfgeräte von Omron Automation können beispielsweise mit Zebra-Thermodruckern verwendet werden, um die Normen ISO 15426 und GS1 der ausstellenden Behörde für die FDA-Konformität zu erfüllen.
Verwandt: Rückverfolgungslösungen von Omron
In anderen Fällen erfolgt die Inline-Prüfung durch spezielle Bildverarbeitungssysteme, die die Förderbänder automatisierter Produktionslinien flankieren und Barcodes lesen, um die UDI-Kennzeichnung von Produkten mit hohem Mischungsverhältnis auf Highspeed-Produktionslinien extrem schnell und genau zu überprüfen. Die MicroHAWK-Angebote von Omron Automation zeichnen sich in diesem Bereich durch moderne Sensoren aus, die durch eine miniaturisierte Konstruktion und Anschlussmöglichkeiten wie Ethernet/IP und PROFINET ergänzt werden.
Verwandt: Vermeiden Sie die Haftung bei falscher Etikettierung
Im Gegensatz dazu eignet sich die Offline-UDI-Prüfung am besten für die Stichprobenprüfung von Etiketten, um die Qualität zu gewährleisten. Die Offline-Prüfung wird häufig für Stichprobenprüfungen eingesetzt, wenn Medizinprodukte eine Einrichtung verlassen oder dort ankommen, und kann Online-Prüfsysteme im Vorfeld des Vertriebswegs ergänzen.
 Abbildung 3: Für direkt auf den Produkten angebrachte UDIs sind andere Prüfgeräte erforderlich als für UDIs auf aufgeklebten Etiketten. (Bildquelle: Omron Automation)
Abbildung 3: Für direkt auf den Produkten angebrachte UDIs sind andere Prüfgeräte erforderlich als für UDIs auf aufgeklebten Etiketten. (Bildquelle: Omron Automation)
Der Einsatz von ISO-konformen Prüfgeräten ist für den gesamten medizinischen Vertrieb und das Gesundheitswesen von Vorteil. Erwägen Sie Offline-UDI-Prüfprodukte der Serie LVS 95XX von Omron. Diese werden wie folgt verwendet:
- Auf Laserbeschriftungsstationen und Etikettendruckern, wo Codes erstellt werden
- Wenn Codes auf Produkte angewendet werden, die von dem Bereich, in dem die Codes erstellt werden, getrennt sein können oder nicht
- In Qualitätskontrollstationen, wo Vorlagen, Formatierungen und andere Codeelemente bestätigt werden
Auswahl der Offline-UDI-Prüfgeräte
Welches Offline-UDI-Prüfgerät für eine bestimmte Anwendung am besten geeignet ist, hängt von mehreren Parametern ab.
Barcodegröße: Große Barcodes sind oft leichter zu scannen, wenn die Identifikatoren ein großes Sichtfeld haben, das durch die Brennweite des Objektivs und die Sensorgröße definiert ist. Ein Beispiel sind die Desktop-UDI-Prüfgeräte LVS-9510 von Omron Automation. Diese Serie von Produkten kann sowohl lineare als auch 2D-Etiketten lesen. Fünf verschiedene Versionen haben jeweils ein unterschiedliches Sichtfeld, so dass die Version ausgewählt werden kann, die mit der Größe des zu prüfenden Barcodes kompatibel ist. Eine Stitching-Funktion ermöglicht das Klassifizieren von Barcodes, die das Sichtfeld überschreiten.
Darüber hinaus können alle LVS-9510 automatisch die Symbologie und die Blende bestimmen, die zur Auswertung des Codes und zur Identifizierung und Hervorhebung von Problemstellen erforderlich sind.
 Abbildung 4: Die Überprüfung von Barcodes, die den ISO-Normen entsprechen, wird durch Geräte erleichtert, die sowohl lineare (1D) als auch zweidimensionale (2D) Codes überprüfen können. Einige dieser Geräte bestimmen die Symbolik und die Blende, die für die Auswertung von Codes erforderlich sind, und identifizieren und markieren Probleme. Der hier gezeigte LVS-9510 verfügt über eine Stitching-Funktion, mit der Barcodes, die größer als das Sichtfeld sind, klassifiziert werden können. (Bildquelle: Omron Automation)
Abbildung 4: Die Überprüfung von Barcodes, die den ISO-Normen entsprechen, wird durch Geräte erleichtert, die sowohl lineare (1D) als auch zweidimensionale (2D) Codes überprüfen können. Einige dieser Geräte bestimmen die Symbolik und die Blende, die für die Auswertung von Codes erforderlich sind, und identifizieren und markieren Probleme. Der hier gezeigte LVS-9510 verfügt über eine Stitching-Funktion, mit der Barcodes, die größer als das Sichtfeld sind, klassifiziert werden können. (Bildquelle: Omron Automation)
Barcode-Typ: Die Scanner müssen die Barcodeformate lesen, die von den Ausgabestellen wie HIBCC, ICCBBA oder (ab 2023 am häufigsten) GS1 zugewiesen werden. GS1 schreibt die Größe, das Format und die Auflösung von UPCs, linearen Barcodes und 2D-Datamatrix-Barcodes vor.
Position der UDI-Kennzeichnung: Betrachten Sie die direkte Teilekennzeichnung (DPM) von Medizinprodukten. Diese Markierungen können unglaublich winzig sein, insbesondere wenn sie chirurgische Instrumente und implantierbare medizinische Geräte kennzeichnen. Zum Lesen und Verifizieren solcher DPM-UDIs sind die ultrakompakten Handprüfgeräte LVS-9580 und LVS-9585 von Omron mit einer Speziallinse ausgestattet, die eine Vielzahl von DPMs klassifizieren kann, einschließlich solcher mit einer Zellgröße bis hinunter zu 0,002 Zoll. Die industrietauglichen Linsen im Inneren des LVS-9580 und LVS-9585 gewährleisten eine gleichbleibende Lesegenauigkeit. Am ausgefeiltesten sind die hochgradig kontrollierbaren und kalibrierbaren Beleuchtungstechnologien in den Scannern. Zusammen mit den verschiedenen Sichtfeldern ermöglicht die Beleuchtung eine sofortige Optimierung der aufgenommenen UDI-Bilder. Dies ist besonders wichtig, da der Code-Standard keine nachträglichen Korrekturen oder Bildmanipulationen zulässt.
Mehr über UDI-Scanner-Software
Um maximale Effizienz zu erreichen, muss die UDI-Software zur Unterstützung der Prüfgeräte die Diagnoseinformationen in einem intuitiven Format darstellen. Diese Software muss UDI-Codes nach ISO-definierten Parametern bewerten (vor allem, um die Lesbarkeit zu bestätigen) und sollte idealerweise auch die Verschlechterung von Problemen über eine Reihe von UDI-Scans verfolgen.
Omron liefert mit jeder seiner UDI-Scanner-Hardware die erforderliche Software mit. Die Software wird regelmäßig aktualisiert, um mit den sich schnell entwickelnden Vorschriften und neuen Gesetzen der Branche Schritt zu halten.
Eine wichtige Funktion der Omron-Scanner-Software ist die Handhabung der Codesyntax. Kurz gesagt, jeder Barcode oder 2D-Code muss alle relevanten Informationen wie Produkttyp, Chargennummer, Menge, Verfallsdatum, Versandinformationen usw. genau erfassen. Die daraus resultierenden Datenstrings müssen in einer bestimmten Weise formatiert werden, um mit den sich entwickelnden Anforderungen, Methoden und Bestimmungsorten für medizinische Produkte Schritt zu halten.
Die regelmäßig aktualisierte Software des Scannerherstellers stellt sicher, dass die Endbenutzer auch bei der Veröffentlichung neuer Codes auf dem neuesten Stand bleiben.
Fazit
Das US-Militär hatte einst das Ziel, ein UID-Produktverfolgungssystem nach dem Vorbild des UDI-Systems in der Medizinbranche vollständig einzuführen. Damit sollte die massive Verschwendung von verlorenen, duplizierten und nicht gezählten Lieferungen in Militäreinrichtungen eingedämmt werden, die von fertigen Raytheon-Waffen bis zu Steuerplatinen reichten, die von einem kleinen Unternehmen für eine spezielle Anwendung geliefert wurden. Heute werden UIDs in unterschiedlichem Maße genutzt.
Dies wird nicht das Schicksal des UDI-Mandats sein.
Das Mantra, das die Einführung der UDI vorantreibt, ist einfach: Das Etikett ist das Produkt. Schließlich kann ein falsches Etikett eine Kette von Ereignissen auslösen, die das medizinische Personal Zeit kostet und dazu führt, dass das Medizinprodukt weggeworfen wird. Daher müssen UDIs auf allen Ebenen der Verpackung erscheinen, z. B. auf der Ebene der Einheit, der Verpackung, des Pakets, der Kiste und der Palette. UDIs auf sterilen Medizinprodukten innerhalb von Sterilisationssiegeln sind besonders wichtig, da ein Aufbrechen des Siegels zur Überprüfung des Produkttyps nicht akzeptabel ist.
Da die FDA ab dem 24. September 2023 die vollständige Einhaltung der UDI-Richtlinien vorschreibt, werden moderne Scantechnologien zur Verifizierung medizinischer Produkte für Automatisierungshersteller sowie für die von ihnen belieferten Gerätehersteller und Endanwender von größter Bedeutung sein.
Solche Scanner können die äußerst spezifischen UDI-Anforderungen der FDA erfüllen, um Etiketten auf einer Vielzahl von Labor-, Medizin- und klinischen Diagnosegeräten zu bestätigen. Offline-Barcode-Prüfgeräte maximieren die Rückverfolgbarkeit, die maschinelle Inline-Bilderfassung und moderne DPM-Lesegeräte.

Haftungsausschluss: Die Meinungen, Überzeugungen und Standpunkte der verschiedenen Autoren und/oder Forumsteilnehmer dieser Website spiegeln nicht notwendigerweise die Meinungen, Überzeugungen und Standpunkte der DigiKey oder offiziellen Politik der DigiKey wider.









