Le tecnologie per l'identificazione univoca dei dispositivi automatizzano la lettura dei codici a barre e degli ID in campo medico
Contributo di Editori nordamericani di DigiKey
2023-10-26
Nel 2013, la Food and Drug Administration (FDA) statunitense ha implementato il sistema di identificazione univoca dei dispositivi o regola UDI. La norma mirava a migliorare la sicurezza dei pazienti fornendo un metodo coerente di tracciabilità e identificazione dei dispositivi medici utilizzando una documentazione moderna nei punti di produzione, distribuzione e utilizzo. Analogamente ai requisiti normativi sui dispositivi medici in Europa o a normative simili in altri Paesi, la norma UDI statunitense aumenta l'accuratezza della segnalazione e facilita l'analisi in caso di ritiro o evento avverso.
A partire dal 24 settembre 2023, la FDA applicherà pienamente il National Health Related Item Code e i numeri di codice dei farmaci sulle etichette e sulle confezioni dei dispositivi. Tutti i prodotti medici etichettati a partire da tale data devono essere pienamente conformi ai requisiti UDI. Questo mandato avrà un impatto su quanto segue:
- Prodotti di classe 3 essenziali per la vita, come pacemaker e protesi impiantate
- Prodotti di classe 2 moderatamente critici, come siringhe, cateteri e suture riassorbibili
- Prodotti di classe 1 a basso rischio, come filo interdentale, camici medici e le maschere di ossigeno
La piena applicazione del mandato significa che se un dispositivo medico non ha un codice a barre scansionabile, non sarà più considerato un prodotto valido/utilizzabile, anche se su di esso sono presenti etichette leggibili dall'uomo e anche se si ritiene che il prodotto sia generalmente di facile identificazione da parte della maggior parte degli utenti. L'applicazione integrale della normativa stimolerà l'adozione completa da parte del settore medicale e della fatturazione alle assicurazioni mediche private.
 Figura 1: Alcuni verificatori portatili di codici a barre DPM (Direct Part Mark) sono dotati di un'illuminazione avanzata e di software per individuare automaticamente i simboli e passare attraverso le impostazioni per ottimizzare la lettura dello specifico marchio DPM e del substrato di materiale a disposizione. LVS-9585, qui illustrato, è in grado di verificare sia i pezzi DPM che le etichette stampate per un'analisi e una reportistica complete. (Immagine per gentile concessione di Omron Automation)
Figura 1: Alcuni verificatori portatili di codici a barre DPM (Direct Part Mark) sono dotati di un'illuminazione avanzata e di software per individuare automaticamente i simboli e passare attraverso le impostazioni per ottimizzare la lettura dello specifico marchio DPM e del substrato di materiale a disposizione. LVS-9585, qui illustrato, è in grado di verificare sia i pezzi DPM che le etichette stampate per un'analisi e una reportistica complete. (Immagine per gentile concessione di Omron Automation)
L'ente appaltante (titolare del marchio) è responsabile
Negli Stati Uniti, il titolare della proprietà intellettuale e il marchio rivolto all'utente di ogni prodotto medico sono responsabili dell'accuratezza e della qualità dei codici UDI. Questo aspetto è particolarmente importante in quanto gran parte del mercato dei prodotti medici è dato in appalto e affidato a strutture di altre società. Pertanto, è responsabilità della società contraente assicurarsi che l'intera supply chain sia conforme agli UDI e produca etichette accurate.
Origini della tecnologia di identificazione dei dispositivi
Gli UDI sono identificativi statici di dispositivi. Tuttavia, le modifiche alla quantità di articoli contenuti in una confezione possono rendere necessario un nuovo identificativo. Gli enti emittenti decidono come distinguere questi dettagli. Analogamente, la modifica delle condizioni di sterilità del confezionamento di un dispositivo può modificare anche l'identificativo del dispositivo. Anche la modifica del mercato di destinazione (il Paese in cui il dispositivo sarà venduto), della lingua dell'etichetta o del marchio CE possono richiedere la modifica dell'identificativo del dispositivo.
Prima della norma UDI, un produttore di dispositivi medici poteva etichettare un prodotto con un particolare codice componente. Il distributore poteva cambiare il codice componente prima che l'operatore sanitario o l'ospedale lo cambiasse di nuovo. Vista la possibilità che ogni entità potesse cambiare il codice componente di un prodotto prima di raggiungere il paziente, era quasi impossibile tracciare i prodotti, gestire i ritiri, prevenire le contraffazioni o ordinare le nuove scorte con efficienza.
Correlato: Implementazione di soluzioni di tracciabilità robuste
Attualmente, a ogni dispositivo viene assegnato un identificativo standardizzato e persistente, chiamato UDI, per consentire a tutte le entità l'identificazione più rapida e precisa del dispositivo, riducendo in ultima analisi gli errori medici. L'UDI è un codice alfanumerico che contiene due dati fondamentali:
- Un identificativo del dispositivo
- Un identificativo di produzione
Un identificativo di dispositivo è un'etichetta statica assegnata a un determinato dispositivo che riporta l'etichettatore (in genere il produttore del dispositivo) e lo specifico numero di modello del dispositivo. Invece, un identificativo di produzione contiene dati che possono variare e molti dei dati che può contenere sono opzionali. Questi possono includere i codici di lotto e di partita, i numeri di serie, le date di scadenza e le date di produzione. In breve, i dati opzionali possono essere qualsiasi cosa un produttore o un etichettatore ritenga necessaria per supportare la tracciabilità del dispositivo.
Ogni etichetta UDI deve presentare queste informazioni in due forme:
- Forma leggibile dall'uomo (testo normale)
- Forma leggibile a macchina (leggibile da uno scanner di codici a barre o da un lettore RFID)
Se un dispositivo può soddisfare più applicazioni mediche, l'UDI deve essere apposto direttamente sul dispositivo, non sulla sua confezione. La regola vale anche per i dispositivi multiuso.
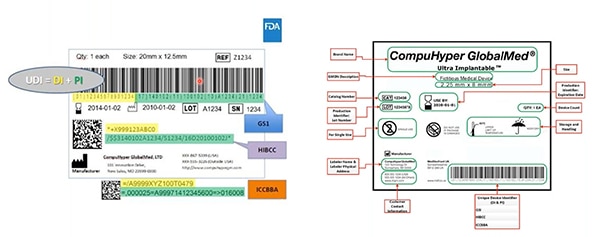 Figura 2: GS1, HIBCC e ICCBBA sono enti di emissione degli UDI; assegnano agli UDI la simbologia consentita; definiscono quali tecnologie possono interfacciarsi con gli UDI e specificano la qualità richiesta dei marchi UDI. In giallo è evidenziato l'identificativo di dispositivo; in verde gli identificativi di produzione. Altri elementi includono informazioni leggibili dall'uomo... e anche queste sono codificate nel codice a barre leggibile a macchina. (Immagine per gentile concessione di FDA)
Figura 2: GS1, HIBCC e ICCBBA sono enti di emissione degli UDI; assegnano agli UDI la simbologia consentita; definiscono quali tecnologie possono interfacciarsi con gli UDI e specificano la qualità richiesta dei marchi UDI. In giallo è evidenziato l'identificativo di dispositivo; in verde gli identificativi di produzione. Altri elementi includono informazioni leggibili dall'uomo... e anche queste sono codificate nel codice a barre leggibile a macchina. (Immagine per gentile concessione di FDA)
Tutti i dispositivi devono essere registrati nel database UDI globale per consentire la tracciabilità in caso di ritiro e per dare al pubblico accesso alle informazioni su un determinato dispositivo. Le agenzie di emissione accreditate dalla FDA sono autorizzate a creare identificativi unici che i produttori di dispositivi possono apporre sui loro prodotti.
White paper correlato: Essere se,pre aggiornati in fatto di tracciabilità
Tecnologie e tecniche di scansione UDI
Le etichette UDI possono essere verificate in diversi modi lungo il percorso dalla produzione all'utilizzo.
La verifica in linea viene eseguita da tecnologie integrate in macchinari più grandi per l'elaborazione rapida e accurata di un gran numero di prodotti durante la produzione. Supportate da un software avanzato, queste tecnologie assumono talvolta la forma di stampanti di etichette di grado industriale. Queste stampanti sono in grado di effettuare una verifica in linea per confermare che le informazioni UDI siano leggibili secondo i rigorosi standard del settore immediatamente dopo la loro creazione nel punto di produzione dell'etichetta. Ad esempio, i verificatori V275 di Omron Automation possono essere utilizzati con le stampanti termiche Zebra per soddisfare gli standard ISO 15426 e gli standard GS1 degli enti di emissione per la conformità FDA.
Correlato: Soluzioni di tracciabilità di Omron
Altrove, la verifica in linea assume la forma di visione artificiale specializzata che affianca i nastri trasportatori delle linee di produzione automatizzate, incorporando la lettura dei codici a barre per una verifica estremamente rapida e accurata dell'etichettatura UDI su prodotti di vario tipo su linee di produzione ad alta velocità. Le offerte MicroHAWK di Omron Automation eccellono in questo settore con sensori avanzati integrati da una struttura miniaturizzata e opzioni di connettività che includono Ethernet/IP e PROFINET.
Correlato: Evitare le conseguenze degli errori di etichettatura
La verifica UDI offline invece è più adatta per il campionamento di lotti di etichette ai fini di garanzia della qualità. Spesso impiegata per l'analisi dei campioni quando i dispositivi medici lasciano o arrivano in una struttura, la verifica offline può integrare i sistemi di verifica online a monte del percorso di distribuzione.
 Figura 3: Gli UDI marcati direttamente sui prodotti richiedono verificatori diversi da quelli utilizzati per gli UDI stampati sulle etichette applicate. (Immagine per gentile concessione di Omron Automation)
Figura 3: Gli UDI marcati direttamente sui prodotti richiedono verificatori diversi da quelli utilizzati per gli UDI stampati sulle etichette applicate. (Immagine per gentile concessione di Omron Automation)
In effetti, tutte le operazioni di distribuzione medica e sanitaria possono trarre vantaggio dall'uso di verificatori conformi alle norme ISO. Considerate i prodotti di verifica UDI offline serie LVS 95XX di Omron. Questi sono impiegati:
- Sulle stazioni di marcatura laser e sulle stampanti di etichette in cui vengono creati i codici
- Ovunque i codici siano applicati ai prodotti, un'area che può essere o meno separata dall'area di creazione dei codici
- Nelle stazioni di controllo qualità, dove vengono confermati i modelli, la formattazione e altri elementi del codice
Specificare le variazioni del verificatore UDI offline
Il verificatore UDI offline più adatto per una determinata applicazione dipende da diversi parametri.
Dimensioni del codice a barre: i codici a barre di grandi dimensioni sono spesso più facili da scansionare con dispositivi che hanno un ampio campo visivo definito dalla lunghezza focale dell'obiettivo e dalle dimensioni del sensore. Considerate i verificatori UDI da tavolo LVS-9510 di Omron Automation. Questa serie di prodotti è in grado di leggere etichette lineari e 2D. Cinque diverse versioni, ciascuna con un campo visivo diverso, consentono ai progettisti di scegliere la versione compatibile con le dimensioni del codice a barre da verificare. Una speciale funzione di unione consente di interpretare i codici a barre che superano il campo visivo.
Inoltre, tutti i dispositivi LVS-9510 possono determinare automaticamente la simbologia e l'apertura necessarie per valutare il codice, identificare ed evidenziare i punti problematici.
 Figura 4: La verifica di codici a barre conformi agli standard ISO è facilitata da apparecchiature in grado di verificare sia i codici lineari (1D) sia quelli bidimensionali (2D). Alcune di queste apparecchiature determinano la simbologia e l'apertura necessarie per valutare i codici, identificano ed evidenziano i problemi. Il modello LVS-9510 qui illustrato è dotato di una funzione di unione che consente di interpretare i codici a barre che superano il campo visivo. (Immagine per gentile concessione di Omron Automation)
Figura 4: La verifica di codici a barre conformi agli standard ISO è facilitata da apparecchiature in grado di verificare sia i codici lineari (1D) sia quelli bidimensionali (2D). Alcune di queste apparecchiature determinano la simbologia e l'apertura necessarie per valutare i codici, identificano ed evidenziano i problemi. Il modello LVS-9510 qui illustrato è dotato di una funzione di unione che consente di interpretare i codici a barre che superano il campo visivo. (Immagine per gentile concessione di Omron Automation)
Tipo di codice a barre: gli scanner devono leggere i formati di codice a barre assegnati dagli enti emittenti, come HIBCC, ICCBBA o (più comunemente dal 2023) GS1. GS1 stabilisce le dimensioni, il formato e la risoluzione degli UPC, dei codici a barre lineari e dei codici a barre a matrice di dati 2D.
Posizione del marchio UDI: considerate la marcatura diretta delle parti (DPM) dei dispositivi medici. Queste marcature possono essere incredibilmente piccole, soprattutto quando identificano strumenti chirurgici e dispositivi medici impiantabili. Per la lettura e la verifica di questi UDI DPM, i verificatori portatili ad altissima densità LVS-9580 e LVS-9585 di Omron sono dotati di una lente specializzata in grado di interpretare una miriade di DPM, compresi quelli con celle dalle dimensioni inferiori a 0,05 mm. Le lenti di grado industriale all'interno di LVS-9580 e LVS-9585 garantiscono una precisione di lettura costante. Le più sofisticate sono le tecnologie di illuminazione altamente controllabili e calibrabili all'interno degli scanner. Oltre ai molteplici campi visivi, l'illuminazione consente di ottimizzare immediatamente le immagini UDI acquisite. Ciò è particolarmente importante perché lo standard di codice non ammette correzioni o manipolazioni dell'immagine a posteriori.
Ulteriori informazioni sul software per scanner UDI
Per la massima efficacia, il software UDI a supporto dell'hardware di verifica deve presentare le informazioni diagnostiche in un formato intuitivo. Questo software deve classificare i codici UDI in base a parametri definiti dall'ISO (soprattutto per confermarne la leggibilità) e, idealmente, dovrebbe anche tener traccia dei problemi di peggioramento su una serie di scansioni UDI.
Omron include tutto il software necessario con ogni hardware di scansione UDI. Il software viene regolarmente aggiornato per restare al passo con la rapida evoluzione delle normative e delle nuove legislazioni di settore.
Una delle funzioni principali del software per scanner di Omron è la gestione della sintassi dei codici. In breve, ogni codice a barre o codice 2D deve estrarre con precisione tutte le informazioni pertinenti, tra cui il tipo di prodotto, il numero di lotto, la quantità, la data di scadenza, le informazioni di spedizione, ecc. Le stringhe di dati risultanti devono essere formattate in modo particolare per restare al passo con l'evoluzione dei requisiti, delle metodologie e delle destinazioni dei prodotti medicali.
Il software regolarmente aggiornato dal produttore dello scanner garantisce che gli utenti finali siano sempre aggiornati anche quando vengono rilasciati nuovi codici.
Conclusione
Un tempo l'esercito americano mirava a impiegare completamente un sistema UID (ID univoco) per il tracciamento dei prodotti, come il sistema UDI del settore medicale. Lo scopo era quello di ridurre i massicci sprechi associati a forniture perse, duplicate e non conteggiate presso le basi militari, dagli armamenti Raytheon completati alle schede di controllo fornite da una piccola azienda per un'applicazione specializzata. Oggi gli UID sono utilizzati a livelli diversi.
La stessa sorte non toccherà al mandato UDI.
Il mantra che guida l'adozione degli UDI è semplice: L'etichetta è il prodotto. Dopotutto, un'etichetta errata può causare un effetto domino di eventi avversi, che fa perdere tempo al personale medico e porta allo spreco del dispositivo medico. Pertanto, gli UDI devono comparire su tutti gli strati dell'imballaggio, ad esempio a livello di unità, confezione, pacchetto, cassa e pallet. Gli UDI sui dispositivi medici sterili all'interno dei sigilli di sterilizzazione sono particolarmente importanti, poiché la rottura del sigillo per verificare il tipo di dispositivo è inaccettabile.
Poiché la FDA richiede la piena adesione alle direttive UDI a partire dal 24 settembre 2023, le tecnologie di scansione avanzate per la verifica dei prodotti medicali diventeranno fondamentali per i produttori di automazione, i costruttori di macchine e gli utenti finali a cui si rivolgono.
Tali scanner sono in grado di soddisfare i requisiti UDI della FDA, estremamente specifici, per confermare le etichette su un'ampia gamma di apparecchiature di laboratorio, mediche e di diagnostica clinica. I verificatori di codici a barre offline e i lettori DPM avanzati massimizzano la tracciabilità, con capacità di visione artificiale.

Esonero della responsabilità: le opinioni, le convinzioni e i punti di vista espressi dai vari autori e/o dai partecipanti al forum su questo sito Web non riflettono necessariamente le opinioni, le convinzioni e i punti di vista di DigiKey o le sue politiche.









